Rétinopathie du prématuré, principale cause de cécité infantile. Analyse & recherche à l'hôpital universitaire Necker-Enfants malades

La rétinopathie du prématuré est la principale cause de cécité infantile. De fait, dans certains pays, jusqu'à 10% des cécités lui seraient dues, soit plus de 30 000 cas de malvoyance dans le monde en 2010. En France et en Europe, environ 30% des prématurés de moins de 31 semaines d’âge gestationnel développent une rétinopathie, et environ 5% nécessitent un traitement. Le point sur cette pathologie, les prises en charge actuelles et les espoirs de traitements avec le Pr Dominique Bremond-Gignac et le Dr Alejandra Daruich, de l’Hôpital Universitaire Necker-Enfants malades.
La rétinopathie du prématuré (ROP) est une affection des nourrissons nés avant le terme due à une croissance anormale de petits vaisseaux sanguins dans la partie postérieure de l’œil, la rétine. Si son taux d'incidence est similaire entre les populations noire et caucasienne, cette dernière présente une évolution plus fréquente vers des formes graves. De plus, cette incidence varie selon le niveau des soins néonatals et des ressources disponibles, et augmente avec l’amélioration de la survie des nouveau-nés prématurés.

Dr Alejandra Daruich, Service d’Ophtalmologie, Hôpital Universitaire Necker-Enfants malades, AP-HP. Référent ROP. Université Paris Cité. Inserm UMRS 1138, Equipe 17, physiopathologie et innovation thérapeutique en ophtalmologie

Pr Dominique Bremond-Gignac, cheffe du Service d’Ophtalmologie, Hôpital Universitaire Necker-Enfants malades, AP-HP. Université Paris Cité. Inserm UMRS 1138, Equipe 17, physiopathologie et innovation thérapeutique en ophtalmologie. Coordonnatrice du Centre de référence de maladies rares en ophtalmologie (OPHTARA), membre du réseau européen de référence (ERN-EYE).
Rétinopathie du prématuré : causes, diagnostic et résolution spontanée
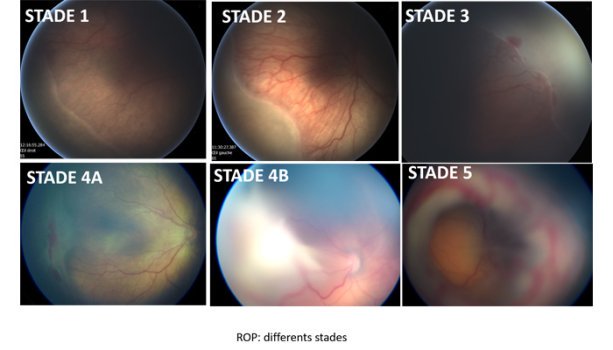
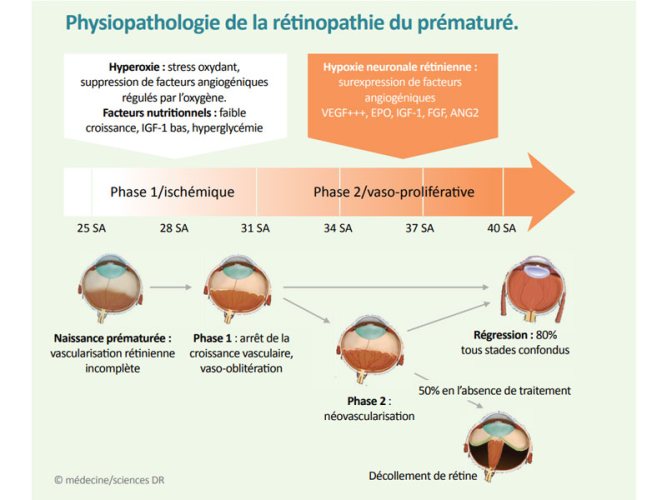
Au moment de la naissance prématurée, le développement rétinien est incomplet, laissant des zones avasculaires, propices au développement de la ROP. Celle-ci est constituée d’une première phase dite « ischémique », d’arrêt du processus de vascularisation rétinien. En conséquence, certaines zones de la rétine vont se retrouver en hypoxie, ce qui va provoquer la sécrétion de facteurs pro-angiogéniques, dont le VEGF (vascular endothelial growth factor). La rétine va alors être sujette à une phase dite « proliférative », une angiogenèse intravitréenne anarchique, qui peut conduire à la formation d’une fibrose cicatricielle. En l’absence de prise en charge, celle-ci risque de provoquer un décollement de la rétine, avec des conséquences sévères en termes de perte de vision. Généralement bénigne, la ROP tend la majeure partie du temps à régresser spontanément. Les enfants prématurés sont cependant plus à risque de développer d’autres problèmes oculaires comme une myopie, un strabisme et une amblyopie.
Si les mécanismes physiopathologiques qui sous-tendent la phase ischémique de la ROP sont complexes et encore mal connus, la sévérité de l’atteinte a pu être associée à une hyperoxie à la naissance et à des fluctuations de l'oxygénation pendant la période néonatale. La surveillance stricte du taux d’oxygène dans le sang est donc essentielle chez les nouveau-nés nécessitant une supplémentation en oxygène. Un faible poids et un faible âge gestationnel, ainsi qu’une faible croissance postnatale sont également des facteurs pronostiques de la rétinopathie. Les transfusions sanguines sont également associées au développement de la ROP. Plus généralement, la sévérité des signes cliniques de la pathologie corrèle avec le degré de prématurité.
La rétinopathie du prématuré étant une pathologie de la rétine périphérique, elle est asymptomatique dans ses premiers stades et ne peut être diagnostiquée que par un examen minutieux du fond d’œil par un ophtalmologiste spécialisé. En France, cet examen est recommandé sur tous les prématurés de moins de 1 250 grammes à la naissance, ou nés avant 31 SA. Répété toutes les 1 à 3 semaines en fonction de la sévérité de l’atteinte, et ce jusqu’à complétion de la croissance des vaisseaux de la rétine, cet examen vise à une prise en charge rapide si apparaissent des signaux d’alarmes qui pourraient mener au décollement de la rétine. De plus, l’observation de réactivations de la rétinopathie à l’adolescence et à l’âge adulte nécessite un suivi long terme des patients ayant présenté une ROP.
"Aujourd'hui, quand on traite la rétinopathie, ce que l'on traite ce sont les complications. L’enjeu, le vrai progrès, ce serait de prendre en charge plus tôt, de la traiter en phase I, avant qu’il y ait des dégâts"
Prise en charge des atteintes sévères de rétinopathie du prématuré
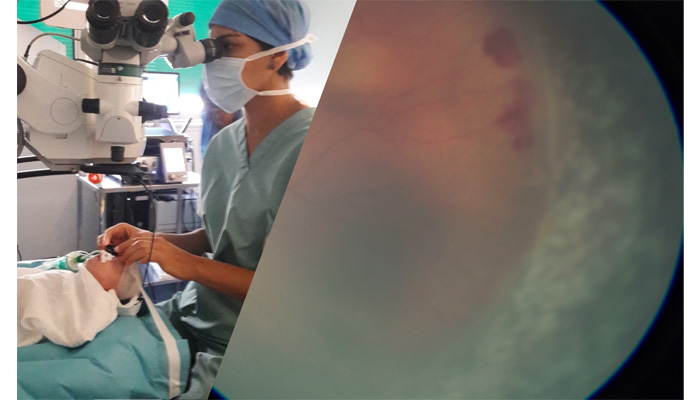
Délicate, la prise en charge de la ROP demande une étroite collaboration entre ophtalmologistes, néonatologistes et anesthésistes pédiatriques. Plusieurs options de traitements sont disponibles, en fonction de la sévérité de la pathologie, de sa localisation et de son extension. Sur les cinq stades décrivant la sévérité de la maladie, les deux derniers sont liés à la présence et à l’étendue d’un décollement de la rétine.Le traitement de choix consiste en une photocoagulation par laser. Effectué sous anesthésie générale, il consiste à détruire la rétine avasculaire par des impacts lasers pour diminuer la production des facteurs promouvant la néovascularisation. Dans les 9 semaines post-traitement, le taux d’échec se révèle inférieur à 9% avec comme complication majeure une myopie dont la sévérité est corrélée à l’étendue de la ROP et donc au nombre d’impacts nécessaire à sa destruction. Ce traitement, qui bénéficie de plusieurs décennies de recul, permet de faire passer le risque d’évolution de la ROP vers des complications type décollement de la rétine de 48 à 27%. Sur le plan de la perte d’acuité visuelle, le risque passe quant à lui de 62 à 44%.
Dans les cas d’atteinte sévère avec décollement de la rétine, le recours à la chirurgie est nécessaire. L’objectif est ici de soulager les tractions s’exerçant sur la rétine, pour permettre sa ré-application. Dans plus de 90% des ROP en stade précoce de décollement, la ré-application de la rétine est un succès, et le cristallin est préservé. Pour les stades plus avancés, la chirurgie, plus complexe, peut néanmoins être couronnée de succès dans un tiers des cas, mais le pronostic visuel reste limité. Il est important de signaler qu’une perception lumineuse est très précieuse dans ces cas extrêmes.
Les anti-VEGF, une option sûre ?
Pour bloquer la phase proliférative de la ROP, une option en cours d’évaluation est l’utilisation d’anticorps anti-VEGF, qui viendraient neutraliser le facteur à l’origine de la néovascularisation anarchique. Cette procédure, qui nécessite une injection intra-vitréenne, expose aux risques d’endophtalmie et de cataracte, contrairement à la photocoagulation laser, qui est une procédure extraoculaire. Cependant, elle a l’avantage de pouvoir être effectuée sous anesthésie locale, sans intubation. Tout du moins en théorie, car en pratique, l’anesthésie générale se révèle fréquemment nécessaire. Si une méta-analyse récente suggère que ce traitement aurait une efficacité similaire à celle de la photocoagulation laser, il reste cependant des doutes à lever concernant la posologie optimale et la sécurité à long terme de ce type d’approche. En effet, après leur injection, ces anticorps peuvent passer dans la circulation sanguine et y rester plusieurs semaines. Or le VEGF est un élément clé du développement physiologique du cerveau, des reins et des poumons. De plus amples données sont donc nécessaires pour déterminer la place que pourrait occuper ce traitement dans l’arsenal anti-ROP.
Le fer, suspect tout désigné
Ces dernières années, un faisceau de preuve semble indiquer que le fer pourrait être une cible d’intérêt dans cette pathologie. Connu depuis longtemps pour s’accumuler dans les cas de dégénérescence rétinienne, il semblerait qu’il joue également un rôle dans la DMLA, la rétinopathie diabétique, et… le décollement rétinien. En effet, le Dr Daruich en collaboration avec Emilie Picard et l’équipe INSERM 1138 dirigé par le Pr Francine Behar-Cohen, ont montré en 2019 qu’on retrouve des taux de fers plus élevés dans l’œil des patients opérés pour un décollement rétinien que pour d’autres indications. La même constatation a pu être faite sur des modèles animaux de décollement de la rétine. Le fer pourrait donc être une cible thérapeutique. Indispensable au bon fonctionnement de nos cellules, le fer peut également favoriser un stress oxydant lorsqu’il est présent en trop grande concentration. Et donc entraîner la mort cellulaire. Des expériences menées par le Dr Daruich et ses collègues ont d’ailleurs montré que l’injection à des modèles animaux de décollement rétinien de molécules capables de fixer le fer libre provoque une diminution de la mort des photorécepteurs, de l’inflammation, du stress oxydant et de façon générale des dégâts anatomiques. Ceci a d’ailleurs amené les chercheuses à proposer l’utilisation de telles molécules chélatrices du fer en post-opératoire, pour améliorer le pronostic de récupération chez les patients opérés pour un décollement de la rétine.
« En effet, le décollement de la rétine est une urgence chirurgicale car les photorécepteurs commencent à mourir dès 6 h après le décollement. Le patient doit être amené au plus vite au bloc opératoire car plus il se passe de temps avant la prise en charge et moins la récupération visuelle sera bonne. Mais même si la chirurgie est effectuée très rapidement, les neurones auront souffert. La récupération n’est donc jamais de 100%. Dans la plupart des cas, on est plutôt à 50% », précise le Dr Daruich.
© DR
Un facteur aggravant et une piste de traitement pour la ROP ?
Cependant « s’il existe bien une association entre transfusions sanguines chez les prématurés, donc surcharge en fer, et sévérité de la ROP, le rôle du fer dans cette pathologie n’a pas encore été formellement établi, signale le Dr Daruich. Mais on sait qu’une surchage en fer provoque un stress oxydant, tout comme l’oxygénothérapie, qui est le facteur de risque principal pour la ROP ». La chercheuse et ses collègues se sont donc attelés à vérifier ce lien. Pour cela, elle a mis en place une étude en collaboration avec les unités de néonatologie de Port-Royal et Necker. En utilisant les excédents des prélèvements sanguins fait en routines sur les prématurés, les chercheuses testent la corrélation entre le taux de fer sanguin et la survenue ou la sévérité de la rétinopathie des petits patients. En parallèle, elles développent un modèle animal de la ROP, pour pouvoir tester l’efficacité neuroprotectrice des protéines chélatrices du fer.Si leurs hypothèses se révèlent justes, leurs résultats pourraient aboutir à la mise au point d’un traitement à prendre par les prématurés, très précocement. « En effet, conclut la chercheuse, clinicienne et chirurgienne, aujourd'hui, quand on traite la rétinopathie, on arrive déjà trop tard. Ce que l'on traite ce sont les complications. L’enjeu, le vrai progrès, ce serait de prendre en charge plus tôt, de la traiter en phase I, avant qu’il y ait des dégâts. »
Plus encore, leurs travaux pourraient démontrer le rôle du fer, dans la ROP. De quoi impacter toute la prise en charge de la néonatologie.
Propos recueillis par Aline Aurias
Référence :
Rétinopathie du prématuré : de la prévention au traitement. Alejandra Daruich, Dominique Bremond-Gignac, Francine Behar-Cohen and Elsa Kermorvant Med Sci (Paris), 36 10 (2020) 900-907 DOI : https://doi.org/10.1051/medsci/2020163
À lire aussi

Dr Alejandra Daruich-Matet, un projet : adapter les thérapies neuroprotectrices à l'enfant
Suite de notre 2e volet des portraits de "femmes d'excellence" !

Ophtalmopédiatrie : comprendre et traiter les pathologies
Après la rencontre inspirante et éclairante avec la Dr Juliette Pulman à l’Institut de la Vision [lire l'article "L'édition de gènes, une nouvelle ère pour la

Comment voit l'enfant de la naissance à 6 ans
À sa naissance Dès le 5ème mois de grossesse, la future maman peut sentir le fœtus bouger quand il est soumis à une forte illumination, sur la plage par exemple. Sa naissance... le plus beau jour de votre vie, vous vous demandez si votre bébé vous voit et comment…








